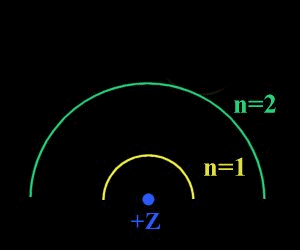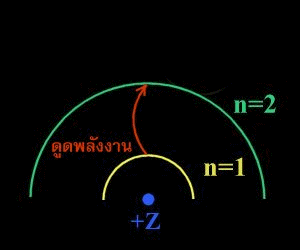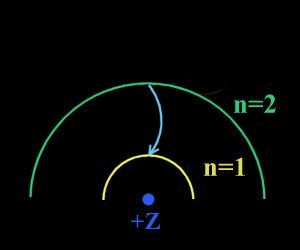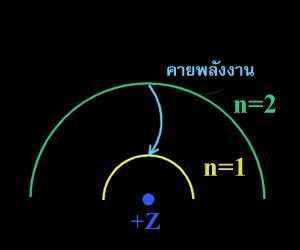
เมื่ออิเล็กตรอนเปลี่ยนวงโคจรจะมีการดูดกลืนหรือเปล่งรังสีแม่เหล็กไฟฟ้า วงโคจรของอิเล็กตรอนที่มีค่า n1 จะมีพลังงานน้อยกว่า n2 ดังนั้น E1 < E2
การเปลี่ยนวงโคจรจาก n1 ไปสู่วงโคจร n2 จะเป็นการดูดกลืนรังสี
การเปลี่ยนวงโคจรจาก n2 ไปสู่วงโคจร n1 จะเป็นการเปล่งรังสี
เนื่องจาก DE = hu ดังนั้นความถี่(u) ของรังสีที่เปล่งออกมาจะมีค่าสูงหรือต่ำจะขึ้นอยู่กับผลต่างของระดับพลังงานทั้งสอง( DE)
บอห์รได้เสนอสูตรสำหรับหา En โดยอาศัยกฎทางกลศาสตร์และไฟฟ้าดังนี้
- me คือ มวลของอิเล็กตรอน (9.11 x 10-28g)
- e เป็นประจุของอิเล็กตรอน (4.8 x 10-10 esu)
- z เป็นเลขอะตอมมิกของไฮโดรเจน (1)
- h คือค่าคงที่ของพลังค์ (6.62 x 10-27 erg-sec)
เมื่อแทนค่า me, e, z, h ที่อยู่ในวงเล็บ ค่าในวงเล็บคือ
2.18 x 10 -11 erg
หรือ 13.6 eV หรือ 1311.65 kJ mol-1
สูตรของบอห์รสำหรับหารัศมีของวงโคจรอิเล็กตรอนที่มีเลขควอนตัม n คือ
a0 = ค่าคงที่เรียกว่า รัศมีของบอห์ร (Bohr radius)
= h2/4p2 mee2
=0.529 Ao
อิเล็กตรอนที่เคลื่อนที่รอบนิวเคลียสที่ระดับพลังงาน n = 1 จะมีพลังงานต่ำสุด (มีค่าเป็นลบ) เมื่อ n มีค่าสูงขึ้นจนกระทั่ง n = infinity จะมีพลังงานสูงสุดคือ เท่ากับศูนย์