 ระดับพลังงานของออร์บิทัลอะตอม
ระดับพลังงานของออร์บิทัลอะตอม
หลักนี้กล่าวว่าไม่มีอิเล็กตรอนคู่หนึ่งคู่ใดในอะตอมเดียวกัน ที่มีเลขควอนตัมทั้งสี่เหมือนกันทุกประการ
หลักนี้บ่งว่าในแต่ละอะตอมมิกออร์บิทัล เรามีอิเล็กตรอนได้อย่างมากที่สุด 2 ตัว โดยที่แต่ละตัวต้องมีสปินต่างกัน อิเล็กตรอนคู่หนึ่งอาจมี n, l, ml เหมือนกันหมด (ซึ่งแปลว่าอยู่ในออร์บิทัลเดียวกัน) ได้ตราบเท่าที่เลขควอนตัมสปินต่างกัน
ระดับพลังงานของออร์บิทัลอะตอมจะเพิ่มตามค่า n สำหรับค่า n เดียวกันระดับพลังงานของออร์บิทัลอะตอมจะขึ้นกับค่า l ด้วย
เช่น ถ้า n=3 พลังงานจะเรียงจากน้อยไปมากดังนี้ 3s < 3p < 3d สำหรับออร์บิทัล p จะมี 3 ออร์บิทัล คือ px, py และ pz มีระดับพลังงานเท่ากัน ส่วนออร์บิทัล d จะมี 5 ออร์บิทัล คือ dx2 - dy2, dz2, dxy, dyz, dxz มีระดับพลังงานเท่ากัน เรียก ปรากฏการณ์ที่หลายฟังก์ชันคลื่นมีระดับพลังงานเท่ากันว่า degeneracy
l = 0 (ออร์บิทัล s) ml = 0 ไม่มี degeneracy
l = 1 (ออร์บิทัล p) ml = +1, 0, -1 ไม่มี degeneracy
l = 2 (ออร์บิทัล d) ml = +2, +1, 0, -1, -2 ไม่มี degeneracy
เมื่อระดับพลังงานหลักมีค่าเท่ากัน ระดับพลังงานย่อยจะเรียงกันจากน้อยไปมาก คือ s < p < d < f เช่น ในระดับ n=3 3s < 3p < 3d เมื่อ n = 1 และ 2 การเรียงของระดับพลังงานจะเป็นไปตามระดับพลังงานหลัก เมื่อ n มีค่าสูงขึ้นไป (ตั้งแต่ n = 3) จะมีการซ้อนกันของระดับย่อย เช่น 4s มีระดับพลังงานต่ำกว่า 3d และ 5s ต่ำกว่า 4d เป็นต้น เมื่อ n มีค่าสูงขึ้นๆ ความแตกต่างระหว่างพลังงานในระดับย่อยต่างๆ จะยิ่งน้อยลงๆ
ใช้ หลักอาฟบาว (Aufbau principle) ในจัดเรียงอิเล็กตรอนในอะตอม ซึ่งสรุปได้ดังนี้
- ใช้หลักของเพาลี ในการบรรจุอิเล็กตรอน คือ ในแต่ละออร์บิทัลจะบรรจุอิเล็กตรอนได้อย่างมากที่สุด 2 ตัว (มีสปินต่างกัน)
- ใช้เครื่องหมาย
 แทนอิเล็กตรอนที่มีสปินขึ้น (spin up)
แทนอิเล็กตรอนที่มีสปินขึ้น (spin up)
- ใช้เครื่องหมาย
 แทนอิเล็กตรอนที่มีสปินลง (spin down)
แทนอิเล็กตรอนที่มีสปินลง (spin down)
- ใช้เครื่องหมาย
 แทนอิเล็กตรอนเดี่ยวในออร์บิทัล
แทนอิเล็กตรอนเดี่ยวในออร์บิทัล
- ใช้เครื่องหมาย
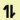 แทนอิเล็กตรอนคู่ในออร์บิทัล
แทนอิเล็กตรอนคู่ในออร์บิทัล
- บรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานต่ำสุดที่ยังว่างก่อน (เรียงลำดับออร์บิทัลตามลูกศรในรูป) จนครบจำนวนอิเล็กตรอนทั้งหมดในอะตอมนั้น การจัดเรียงอิเล็กตรอนแบบนี้จะทำให้อะตอมมีสถานะเสถียรที่สุดเพราะพลังงานรวมทั้งหมดของอะตอมมีค่าต่ำสุด

- การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากันเช่นออร์บิทัล d จะใช้ กฎของฮุนด์ (Hund's rule) คือ"การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน จะบรรจุในลักษณะที่ทำให้มีอิเล็กตรอนเดี่ยวมากที่สุด"
- การบรรจุอิเล็กตรอนที่ทุกๆออร์บิทัล มีระดับพลังงานเป็น degenerate (ระดับพลังงานเท่ากัน) ทุกออร์บิทัลอาจมีอิเล็กตรอนอยู่เต็ม (2 อิเล็กตรอนต่อ 1 ออร์บิทัล) หรือมีอิเล็กตรอนอยู่เพียงครึ่งเดียว (1 อิเล็กตรอนต่อ 1 ออร์บิทัล)
เช่น
Ne : 1s2, 2s2, 2p6
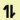
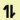
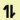
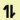
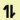 เรียกว่า การบรรจุเต็ม
เรียกว่า การบรรจุเต็ม
N : 1s2, 2s2, 2p3
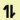
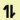


 เรียกว่า การบรรจุครึ่ง
เรียกว่า การบรรจุครึ่ง
โครงแบบอิเล็กตรอนแบบบรรจุเต็มจะเสถียรกว่าแบบบรรจุครึ่งและแบบบรรจุครึ่งก็จะเสถียรกว่าแบบอื่นๆ
เช่น
- 2p6เสถียรกว่า 2p3
- 2p3เสถียรกว่า 2p4
- 3d10เสถียรกว่า 3d9
 ระดับพลังงานของออร์บิทัลอะตอม
ระดับพลังงานของออร์บิทัลอะตอม แทนอิเล็กตรอนที่มีสปินขึ้น (spin up)
แทนอิเล็กตรอนที่มีสปินขึ้น (spin up) แทนอิเล็กตรอนที่มีสปินลง (spin down)
แทนอิเล็กตรอนที่มีสปินลง (spin down)  แทนอิเล็กตรอนเดี่ยวในออร์บิทัล
แทนอิเล็กตรอนเดี่ยวในออร์บิทัล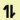 แทนอิเล็กตรอนคู่ในออร์บิทัล
แทนอิเล็กตรอนคู่ในออร์บิทัล

